Vatten
Läxor och prov
7B
9 maj: genomgång av kap 5.1 som är läxa till torsdagen 12 maj. Det är sidorna 78-79 i Spektrum Kemi och sidan 43 i Lightboken. 16 maj förhör 5.2, 23 maj förhör 5.3, 26 maj förhör 5.4.
7F
9 maj: genomgång av kap 5.1 som är läxa till torsdagen 12 maj. Det är sidorna 78-79 i Spektrum Kemi och sidan 43 i Lightboken. 17 maj förhör 5.2, 24 maj förhör 5.3, 26 maj förhör 5.4.
Prov
Det blir förmodligen någon form av inlämningsuppgift eller grupparbetsuppgioft som ska vara klart och inlämnat den 31 maj.
Länkar
Ljudböcker
Talböcker, inlästa texter av boken finns här:
- 5. Vatten
- 5.1 Vattenplaneten jorden
- 5.2 Vatten har ovanliga egenskaper
- 5.3 Vattnet går runt i ett kretslopp
- 5.4 Vattenrening - före och efter användning
- Fokus: Vatten på liv och död
- Sammanfattning
Lektion 1 - Inledning 5.1
Demonstration - Väte brinner
Vi eldar vätgas. Detta för att visa att det bildas vatten från reaktionen mellan luftens syre och väte. Vätgasen kommer från en gastub. Detta är samma experiment som Cavendish en gång gjorde, fast han såg till att där fanns exakt dubbelt så mycket väte som syre. Då såg han att det räckte precis för att skapa vatten. Dessutom vägde han gaserna och det bildade vattnet och såg att gaserna vägde lika mycket som det bildade vattnet. Ett praktiskt sätt att beskriva vad som händer är med reaktionsformeln är 2 H2 + O2 à 2H2O
Jorden = Vattnet
Titta på en satellitbild över jorden så ser du att jorden består till stor del av vatten. Världshaven är större än landområdena. Det mesta av vattnet är saltvatten i haven, cirka 97 %. isarna vid polerna samt glaciärerna innehåller 2 % av jordens vatten. grundvattnet utgör 0,6 % och det sötvatten som finns i sjöar och floder är faktiskt bara några hundradels procent.
Viktigt för livet Vatten är mycket viktigt för allt liv. Växterna använder vatten i fotosyntesen för att skapa socker och växa. Djuren behöver vatten för matspjälkning, blodomlopp mm. Alla celler består till stor del av vatten. Människokroppen består i snitt av ungefär 67 % vatten.
Din vattenförbrukning Varje dag förbrukar vi mycket vatten. Vi badar och duschar, spola toaletter och tvättar kläder, mm. Och så dricker vi förstås ett par liter om dagen. Vi gör av med omkring 200 liter per dag. Hur fördelar sig vattenförbrukningen?
Industriel tillverkning och livsmedelsproduktion Vatten är en viktig del i produktionen. Visste du att det går åt ett ton vatten för att ta fram ett kg ris? Det går åt mycket vatten för att tillverka kläder, falukorv, datorer och allt möjligt. Om räknar samman allt vi använder och hur mycket vatten som har gått åt till detta kommer man fram till att vi förbrukar mycket mer vatten än det vi använder i till tvätt och dryck mm.
Transporter Vatten är ett viktigt transportmedel. hav, sjöar, floder och kanaler har sedan urminnes tider använts för transporter och de används än i dag därför att det är billigt och energisnålt. Golfströmmen värmer upp vattnet och luften utanför skandinavien. Utan den skulle vi ha ett mycket kallare klimat. Golfströmmen transporterar alltså värme. Som vi sa tidigare är vatten viktigt för transporten av näringsämnen, salter, socker, mm i både växter och djur. Det är transport på mikroskala.
Laboration 1 - Vatten i olika former
Säkerhet: Labbrockar, skyddsglasögon.
Demonstration 1 – molnet i en flaska
Molnet i en flaska. En skvätt varmljummet vatten hälls i en stor PET-flaska. Sedan eldar man litet i flaskans mynning. Röken från elden innehåller stoft (partiklar). Från det varma vattnet kommer vattenånga men denna ånga syns inte förrän den bildar små droppar. Dessa droppar bildas genom kondensation på stoftpartiklarna. Runt varje partikel finns alltså litet vatten i form av en droppe. Om man klämmer på flaskan försvinner molnet (vattendropparna) eftersom vattnet övergår till ångfas vid högre tryck. Man kan säga att luften har större förmåga att lösa vattenånga vid ett högre tryck. Detta experiment efterliknar naturen där luften nere vid marken (högt tryck) är molnfri men där ångan kondenserar och bildar moln högre upp i atmosfären (lägre tryck).
Flyter metall på ytspänningen?
Material: Bägare, vatten, metallbit.
Hypotes: Flyter metallbiten?
Skriv resultat
Droppa nu diskmedel på vattenytan. vad händer?
Skriv en slutsats.
Värm kopparsulfat
Säkerhet och kvittblivning: Kopparsulfat är giftigt och miljöfarligt. Använd Skyddsglasögon. Diska inte ut kopparsulfatet i vasken. Det ska hällas i ett kärl i dragskåpet.
Genomförande: Tag en knivsudd kopparsulfat i ett provrör och värm över värmeplattan. Använd en klämma att hålal provröret med. Låt inte provröret komma i kontakt med värmeplattan.
OBS! Diska inte ut kopparsulfatet i avloppet. Det är miljöfarligt.
Lektion 2
Film
Vatten - en global utmaning (DVD 1942) Längd: 16 minuter, från 2010. Den här filmen tangerar So men är ganska givande. 7F o 7B
Vatten och avlopp (VTV 781) Längd: 10 minuter, från 1990. 7F
Om vattenförbrukning kopplat till produkter vi omger oss med: Konsumentmakt : T-shirtar (U51410-02) Längd: 23 minuter, från 2005
En film som har ett biologifokus. Planet Earth - Sötvatten Längd: 58 minuter, från 2008
Handlar mest om djurlivet i grunda vatten. Planet Earth - Grunda vatten Längd: 58 minuter, från 2008
Floder, hav och andra vattendrag (Längd: 13 minuter, från 2007. Det är mer en So-film. Den handlar om olika vattentyper, exempelvis å, bäck, flod, delta, bukt, osv. Den är inte så givande ur ett No-perspektiv. 7F
Lektion 3 - Förhör 5.1 genomgång 5.2
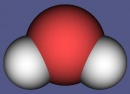

Vattenmolekylen
En vattenmolekylen har två väteatomer och en syreatom. Vatten skrivs H2O med kemispråk. H står för väte och O för syre.
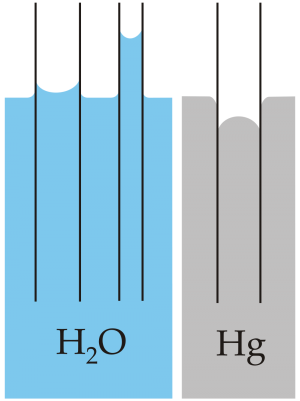
Tyngst vid +4 oC
Vatten har en märklig egenskap. Det har störst densitet vid +4 °C. En liter fyragradigt vatten väger alltså mer än en liter 25-gradigt vatten för att ta ett exempel. Det normala är annars att densiteten för ett ämne ökar ju kallar det är och minskar när värmen ökar. Metaller utvidgas till exempel när de värms upp och det gör ju att deras densitet minskar när de blir varmare.
Is = vatten i fast form
Det vanliga är också att ett ämne blir mindre när det stelnar och tar större plats när det smälter. Is flyter på vatten. Det beror på att isen har lägre densitet. Detta förklaras av att molekylerna sitter i ett glest mönster i isen. Det har att göra med molekylens polaritet. Det är väldigt bra att isenflyter. Inte bara för att vi ska kunna åka skridskor utan för att om isen sjönk skulle det bli svårt för de växter och djur som lever på botten. De skulle frysa inne. Så småningom skulle sjöarna bli bottenfrusna och alla fiskar skulle dö.
Ytspänning
Du kan lägga en metallbit på vattenytan och den flyter fast metall har högre densistet än vatten. Metallen flyter på ytspänningen. Vissa insekter använder detta för att gå på vattnet, exempelvis skräddaren. Man kan se ytspänningen hålla ihop vattnet i en vattendroppe eller om man fyller ett glas över kanten så att vattnet bildar en buktig yta. En vattendroppe som faller är helt klotrund när ytspänningen håller ihop den.
Värmekapacitet
Det går åt mycket ennergi att värma och kyla vatten. Det är en långsam process. temperaturen ändras långsamt för vatten i naturen. Luft värms upp mycket snabbare och svalnar långsammare. Vattent stabiliserar klimatet på detta sätt. Sommaren är ofta bättre i augusti när vattnet fått upp temperaturen så att det stabiliserar klimatet.
Kapillärkraften
Det kallas Kapillärkraft när vattnet sugs upp i smala rör. Växterna utnyttjar detta för att suga upp vatten genom rötterna ioch rören i stjälk och blad. Kapillärverkan gör även att grundvattnet stiger upp mellan sandkornen i marken.
Demo Lägg ett värmeljus i ett vattenbad och värm tills det smälter- SMälter det på ytan först? Sjunker den fasta delen mot botten?
Lektion 4 - 5.3 vattnets kretslopp
Kretsloppet
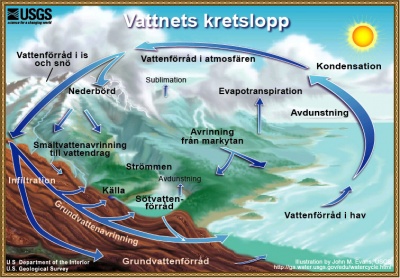
Vattnets kretslopp, den hydrologiska cykeln, är vattnets kontinuerliga flöde mellan havet, atmosfären, vattensamlingar på land, grundvatten och levande organismer.
Det innebär att allt vatten som kommer ned i form av nederbörd strävar efter att ta sig neråt med gravitationens kraft. En del av vattnet färdas via avrinning till lägre marker, och kan rinna ut i exempelvis sjöar. Andra delar av vattnet sjunker neråt genom infiltration och perkolation. När det sjunkit tillräckligt långt hamnar det i grundvattnet.
Solen driver vattnets kretslopp genom att värma upp vattnet i haven. Vatten avdunstar och bildar vattenånga, stigande luftströmmar tar med ångan uppåt i atmosfären där svalare temperaturer får den att kondensera och bilda moln. Luftströmmar transporterar molnen runt jorden, och in över land. En del moln stannar givetvis över havet. Molnpartiklar kolliderar, slås samman, växer och faller till slut ned i form av nederbörd. Beroende på temperaturen kan nederbörd falla som snö eller regn. Nederbörd i form av regn är vanligast, och om den faller på land kan ytvatten bildas, som med gravitationens hjälp söker sig till bäckar och floder för att slutligen mynna ut i havet igen. Allt vatten som faller på land bildar dock inte ytvatten, en del infiltrerar ned i jordtäcket, en del av detta vatten bildar grundvatten. Grundvattnet är en viktig del i vattnets kretslopp. Här finns den stora reserven av sötvattentillgång, som kan rubbas eller skadas beroende på vad som sker i och kring ovanliggande jordlager. En del av det infiltrerade vattnet sjunker inte så djupt att det kan räknas som grundvatten, utan rinner en bit under markytan, för att rinna ut i ett vattendrag. På sikt återvänder vattnet till havet, och cykeln är sluten. Denna text kommer ursprungligen från wikipedia
Förångning och avdunstning När vatten kokar förångas det. Men det kan bildas ånga även utan kokning. Lämnar du vatten i ett glas så kommer det att försvinna så småningom. Då har det dunstat. Vätskan har blivit en gas utan att koka. Det kallas avdunstning. Om inte avdunstningen fanns skulle disken och tvätten aldrig bli torr.
För att förstå hur avdunstningen kan ske måste man till på vattnets molekyler. Molekylerna rör sig ständigt fram och tillbaks huller om buller. en del rör sig snabbare än andra och om det kommer fram till vattenytan kan det hända att de flyger iväg ut i luften och övergår till ångfas. Det här händer utan att temperaturen är100oC. Ju högre temperatur desto snabbare avdunstning.
Vattenånga Man tror ju att man kan se vattenånga men det kan man inte. Det man ser är små små vattendroppar som flyger iväg. Vattenånga syns inte, den är osynlig.
Vattnets kretslopp i korthet: Vatten avdunstar från hav och sjöar. Den vattenångan kondenserar till vattendroppar som smalas i molnen. Sedan regnar det. Regnvatten rinner ut i sjöar och hav igen. En del vattenånga dunstar från växter.
Förbränning skapar vatten Det bildas vatten vid förbränning. Det sker både vid förbränning av kol, gas, olja mm men också i cellens förbränning. Vi andas till exempel ut vattenånga. Det här innebär att vattenmolekylerna tas isär och byggs ihop igen. Kol, syre och väte är byggstenar i naturen. Du hittar dessa grundämnen i socker, vatten och koldioxid, bland annat. Ofta talar man om kolets kemi och ett finare ord är organisk kemi.
Haven är salta Vattnet i haven är salt därför att det har löst upp små mängder salt som finns i sten och jord. Saltet i havet är till största delen den typ av salt vi använder i matlagningen, natriumklorid, NaCl. Det finns också många andra salter i havssaltet.
Glaciärer Glaciärer innehåller sötvatten eftersom de byggs upp av nederbörd.
Lektion 5 - 5.4 Reningsverket
Inledning
Ytvatten Ytvatten kallas det vatten som finns på Jordens yta. Ytvattnet är sjöar, vattendrag, hav och våtmarker. Motsatsen till ytvatten är grundvatten, kan man säga. Ytvattnet blir dricksvatten när det har renats.
Avloppsrening Avloppsvattnet måste renas innan det släpps ut så att det inte smutsar ner våra sjöar. Det är viktigt att ta bort sådana ämnen som skulle kunna skada vår miljö. Reningen är viktig för att förhindra att vi blir sjuka. Dessutom vill vi att vattnet ska ha god smak och lukt.
Dessutom skulle vi få problem med övergödning om vi inte renade avloppsvattnet. Vi måste ta bort näringsämnen från toalettavloppet och tvättmedel.
Avloppsvattnet renas i tre steg: mekanisk rening, biologisk rening och kemisk rening.
Reningsverk är en anläggning där avloppsvatten renas innan det släpps ut i naturen (recipienten). Avloppsvattnet distribueras med hjälp av avloppsledningar och kloaker till reningsverket. I ett traditionellt avloppsreningsverk sker reningen i tre steg: Mekanisk, biologisk och kemisk rening.
Mekanisk rening

Den mekaniska reningen syftar till att avlägsna allt fast material ur avloppsvattnet som skulle kunna störa processen i de senare stegen i reningsverket.
Rensgaller
I rensgallret avskiljs fasta föremål som toalettpapper, Plastpåse|plastpåsar, kondomer med mera. Det fasta avfallet skrapas sedan av från rensgallret och körs till deponi eller förbränning. På senare år har det blivit vanligt att tvätta renset på plats för att minska kvittblivningsvolymen.
Sandfång
För att minska slitaget på pumpar och annan utrustning på reningsverket så skiljer man av sand, grus och andra hårda partiklar. I sandfånget håller man en kontrollerad vattenhastighet så att endast sand och grus sedimenterar men bara mindre mängd biologiskt material. På många reningsverk tvättas även den avskilda sanden för att minska mängden organiskt material till deponi och minska luktproblem när sanden deponeras.
Försedimentering
I försedimenteringen låter man de största biologiska partiklarna sedimentera. Slammet som bildas pumpas bort till slamhanteringen. Vanligtvis är sedimenteringsbassängen även utrustad med ytskrapor som samlar i fett och olja som samlas på ytan.
Biologisk rening
Den biologiska reningen syftar till att med hjälp av mikroorganismer bryta ner och koncentrera organiskt material som är löst i avloppsvattnet och som inte kan sedimenteras bort direkt. Genom att mikroorganismerna lever och förökar sig genom att förbruka lösta näringsämnen i avloppsvattnet så kan man sedan avskilja mikroorganismerna, i till exempel en eftersedimentering. Även avskiljning av kvävenärsalter sker på biologisk väg där närsalterna i flera steg övergår till ofarlig kvävgas.
Aktivt slam
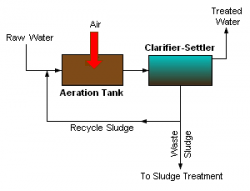
I stora luftningsbassänger får bakterier bryta ner biologiskt material. I den efterföljande sedimenteringsbassängen avskiljs slammet, en del av slammet pumpas tillbaka till luftningsbassängerna för att behålla en bakteriestam i processen, detta kallas returslam. Resterande slam pumpas till slamhanteringen, detta kallas överskottsslam. Det renade Vatten|vattnet leds till det kemiska reningssteget. Luftningen som är den mest energikrävande processen på reningsverket krävs för att mikroorganismerna skall kunna förbruka det organiska materialet som finns upplöst i vattnet aerob. Luften trycks vanligen ned i bassängen med stora kompressorer och blåses ut som bubblor genom perforerade rör, gummimembran eller keramiska material.
Ett vanligt förekommande sedimenteringsproblem är så kallad slamsvällning, som kan orsakas av filamentbildande (trådformiga) bakterier. Dessa påverkar slammet så att det inte blir tillräckligt kompakt vid sedimenteringen, och kan leda till att slam följer med utgående vatten och överbelastar efterföljande filtreringssteg. Detta problem kan leda till att kostnaderna för rening av närsalter och organiskt material ökar, och att förlusten av den aktiva biomassan ut ur systemet kan försämra den biologiska reningen.
Ett försök med att behandla returslam med ozon för att bekämpa filament skedde under 2006-2007 vid Himmerfjärdsverket i Stockholm. Resultaten blev över förväntan och den nya ozontekniken installerades under 2008 som ordinarie behandling i avloppsreningsverket, för att få bukt med filamenten som ställer till med sedimenteringsproblem.
Kemisk rening
Efter mekanisk och biologisk rening finns fortfarande nästan alla fosfater från tvättmedel kvar i vattnet. För att få bort dessa sätter man till kemikalier som till exempel järnklorid eller aluminiumjoner, vilket är vanligast att man använder, som binder fosfaterna. Det bildas en fällning som sjunker till bottnen i en sedimentationsbassäng. Det kemiska slammet som bildas pumpas vidare till slamhanteringen där det efterbehandlas tillsammans med slam från övriga processer.
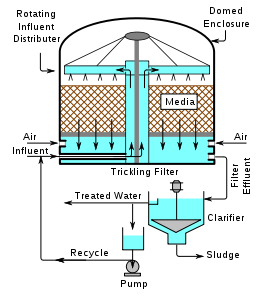
Slamhantering
Syftet med slamhanteringen är att minska volymen på slammet, hindra spridning av smittoämnen samt att minska luktproblemen på det fasta material som måste deponeras eller på annat sätt återanvändas.
Slambehandlingen inleds normalt med en förtjockning för att öka torrsubstanshalten. Den vanligaste typen av förtjockare är sedimenteringsförtjockaren. Förtjockningen minskar betydligt volymen av slammet som skall behandlas. Därefter vidtar själva stabiliseringen av slammet för att bryta ner organiskt material så att slammets volym minskar och förhindra förruttnelseprocesser i slamlagret. Två huvudsakliga metoder för stabilisering förekommer.
Anaerob stabilisering
Genom rötning omvandlas det organiska materialet i slammet utan närvaro av syre (anaerob process) i en rötkammare, slutprodukterna är utrötat slam, slamvatten och rötgas. Rötgasen består av koldioxid, metan och mindre mängder svavelväte, gasen kan renas och användas som fordonsbränsle (biogas).
Aerob stabilisering
Vid aerob stabilisering (slamluftning) sker omvandlingen av organiskt material i närvaro av syre. Processen är enklare att driva än rötningen men ger inte möjlighet att tillvarata den energirika rötgasen. Processen drivs vanligtvis i liknande bassänger som aktivslamprocessen.
Avvattning
Det stabiliserade slammet avvattnas sedan en sista gång för att minska slamvolymen, vattnet som skiljs ut från slammet kallas rejektvatten och återförs till den biologiska reningen. Vanligtvis avänds centrifuger eller olika typer av pressar för att avvattna slamet. De avvattnade slammet kan användas som gödning i fall halterna av tungmetaller är låga, annars deponeras eller förbränns slammet.
Denna text är en omarbetning av denna text från wikipedia
Spel: Här finns ett roligt spel.
Övergödning
Övergödning handlar om att det kommer ut förr mycket kväve och fosfor i sjöar och hav. Detta leder till att det växer för mycket. Det växer igen, det blir syrebrist när växter bryts ned. Det kan leda till algblomning.
Den 6 december 2007 beslutade regeringen att förbjuda fosfater i tvättmedel.
Naturlig rening av vatten
Det finns mycket bra dricksvatten som renas naturligt. Många dricker vatten som pumpas upp ur en brunn, exempelvis på lantstället. Regnvatten, och vatten från snösmältning rinner ner genom marken tills det kommer till grundvattnet många meter ner. När vattnet rinner ner genom marken filtreras det genom sand och jord. I jorden finns bakterier som tar hand om föroreningar mm. Regnvatten är egentligen relativt rent. Det kan vara surt men det regleras när det silas genom sanden.
På landet är det vanligt att avloppsvattnet renas på ett enkelt sätt vid huset för att sedan släppas ut i marken. Detta avlopp blir rent utan att det skickas till reningsverket. Ofta används en enkel trekammarbrunn där partiklar får sjunka till botten. Det slamm som bildas hämtas årligen av en pumpbil. Avloppsvattnet som rinner ur trekammarbrunnen är inte helt rent men det får rinner ner i jorden och renas av sanden. När det når grundvattnet är det renat. Det här fungerar bara där det är glest mellan husen. I städerna måste vi använda reningsverk.
Laboration Vattenrening
Material Smutsigt vatten, ett par bägare, dito trattar, stativ (i trä) med hållare för trattar, filtrerpapper. Extra material kan vara tyg, sand, mossa, hushållspapper, sedimentationskar, mm för varierad rening.
Vad de kommer på: Det behöver filtreras flera gånger. Man kan organisera filtreringen i flera steg ovanför varandra. Det renade vattnet är fortfarande salt.
Utelaboration med karta
Teori pH är ett mått på hur surt/basiskt ditt vattenprov är
Ggenomförnade'
- En karta per person.
- Grupper enligt bestämda platser.
- Beräknad tid: en timme
- Startar med kartgenomgång och testa pH-mätning.
- Sedan ut och jobba.
- Avslutar inne med redovisning på klasswikin.
Aktiviteter ute
Du ska besöka de kontroller som ritats in på kartan. Eller så många kontroller du hinner. Vid varje kontroll ska du utföra ett antal uppgifter som du ser nedan. Du ska skriva ner vad du kommer fram till på varje kontroll. I många fall ska gruppen ta en bild med mobilen (eller en skolkamera som du lånar) eller filma.
Kontroller:
- 1 Mät pH i nån pöl eller fuktig plats. Anteckna vad du fick för värde och platsen du mätte på. Skriv ner vad du tror att det finns för saker som kan påverka pH här och på vilket sätt pH påverkas. Fotografera. Stanna här och ta en titt på omgivningarna. Beskriv naturen så noga du kan med fem meningar.
- 2 Titta på kartan och fundera på varifrån Ravalen får sitt vatten. Gör en pH-mätning i Ravalens vatten. Anteckna. Fotografera.
- 3 Mät ph på vattnet. Leder vattendragen in eller ut ur Ravalen. Fotografera. Hur ser naturen ut här? Fotografera och beskriv med ord. Vilka växter finner du? Fotografera fem olika växter noga. Ser du några fåglar. Vilka? Fotografera om det går.
- 4 Mät ph på vattnet. Vilka djur hittar du här? Fotografera och beskriv naturen. Finns det något annat som kan påverka vattenmiljön negativt? En stor del av Järvafältet är naturreservat. Filma en av gruppmedlemmarna som förklarar varför det är så viktigt att vi har tillgång till naturreservat som detta.
- 5 Mät ph på vattnet i Norrviken. Fotografera och beskriv naturen. Finns det något här som kan påverka vattenmiljön negativt?
Hemma igen: Dokumentera
lägg upp alla bra bilder på klasswikin. gör en egen sida för din grupp. Gör en rubrik för varje kontroll. Lägg in era texter och iaktagelser. Gör en tabell över eera pH-värden.
Extra som vi inte gör idag:
- Mät siktdjupet med hjälp av siktskivan som hänger i ett snöre. Lämna den snyggt upplindad p bryggan.
- Tittskåp
Laboration - Tre laborationer
Spektrum kemi 5.2 och 5.3 har laborationerna 11,10 och 7.
Syfte: Eleverna ska öva sig på att skriva labbrapport. De ska även se en del av vattnets egenskaper.
Eleverna får arbeta enskilt och göra de tre labotrationerna. De får skriva labbrapporter. Det är en utmärkt övning i att lära sig vad som ska stå under varje rubrik i en labbrapport.
Rapporten: Så här ska en rapport se ut
Brev till föräldrar vars elever inte skrev tillräckligt bra rapporter
Laboration - Menthos och läsk
köp en soda stream
Inlämningsuppgift istället för prov
Om du inte klarar denna uppgift innan tisdag vecka 22 kommer du att behöva göra ett traditionellt prov. det finns i infomentor
Uppgifen har två delar, en omfattande teoretisk och en friare mer kreativ. Den första är att du ska skriva en uppsats om ett av följande tre teman:
- vattnets olika former och egenskaper
- vattnets betydels för livet
- vatttnet och miljön
Din uppsats ska vara 3000 - 5000 tecken lång. Den ska innehålla noggranna källhänvisningar. Dina källor ska visa exakt vilken sida du hittat informationen på. Här finns ett exempel på en text som är 5000 tecken lång. Självklart skriver du med dina egna ord. Inlämning: Lämna in en papperskopia med ditt namn överst till höger.
Den andra delen är att du ska göra något av alternativen nedan. Du ska göra en presentation, film eller hemsida i någon form. Det enklaste är att göra presentationen. Här kommer en lista på uppgifter som du kan välja från.
- Gör en presentation (PowerPoint) som sammanfattar din uppsats. Minst fem bilder och bara stödord i punktform. Använd fria bilder.
- Filma och kommentera en laboration.
- Gör en upplysninsfilm om en miljöfråga.
- Lägg in din uppsats på klasswikin och lägg in minst tre fria (CC) bilder med bildertexter och länk till bildens upphovsman. Skapa lämpliga mellanrubriker.
- Gör en wikisida på klasswikin och berätta med ord, bild och film om något som har med vatten men som inte står i boken.
- Gå in på någon av följande ofärdiga sidor på wikipedia och förbättra sidan så det blir en bra presentation. Kontakta mig så att ingen annan jobbar med samma sida. Exempel: http://sv.wikipedia.org/wiki/V%C3%A4rmekapacitet
- Tag en wikipediasida och skriv en sammanfattning som är lätt att läsa för en högstadieelev. Ex http://sv.wikipedia.org/wiki/Moln
Inlämning: Du mejlar din presentation, text, film eller länk till det du gjort.
Bedömning: Denna bedömningsmall används till uppsatsen.
laboration - Mät pH i jord och vatten
Teori: pH är ett mått på surhet eller basiskt. man doppar papperet i det man ska prova och det ändrar färg. man jämför färgen med en skala och får ett värde på pH. Vi testar med kranvatten innan vi går ut.
Material: Tre pH-remsor, tre burkar.
Genomförande. Du ska mäta surhetsgraden för två prover med jord och ett vattenprov. Du ser på kartan var du ska ta ditt vattenprov. Jordproven ska du ta på två ställen som du väljer själv. Till exempel kan du ta ett jordprov nära en väg och ett i skogen. Fukta jordprovet med kranvatten om det behövs för att du ska få utslag på pH-papperet.
Resultat: Resultat av enkel pH-mätning i jord och vatten
Slutsats:
Extrafrågor och uppgifter till sista veckan
Praktisk uppgift: Gå ut och fotografera 10 olika trädsorter. Tag reda på vilka sorter det är. Lägg upp dina träd med namnen på en sida på klasswikin.
- Hur kan man få vatten att leda ström?
- .Varför kokar vatten vid exakt 100oC?
- .Varför är is lättare än vatten?
- .Vad är en jon?
- .Vad finns det för kopplingar mellan pH och miljöförstöring?
- .Om man löser salt i vatten ökar inte volymen. Vad händer med densiteten?
- .Berätta hur vattenmolekylens form påverkar egenskaperna för vatten.
- .Välj tre laborationer eller demonstrationer som du tycker hör ihop. Förklara hur just de experimenten hänger ihop. Ditt motivering kan innehålla resonemang om egenskaper, mätningar, kopplingar mellan kemi och fysik eller helt enkelt en beskrivning hur det fick dig att förstå någonting.
- .Om vi bara skulle göra en laboration eller demonstration under kursen, vilken tycker du att vi skulle välja då? Motivera varför du tycker det experimentet är det viktigaste.
- .Varför är vatten så viktigt för livet på jorden? Berätta om vattnets viktigaste egenskaper. Motivera dina svar.
1) Lektion
Termer och begrepp
Stativ klämma, muff, bägare, degeltång. Ni ska lära er dessa begrepp för att vi ska kunna kommunicera smidigt. Effektiv kommunikation är ett av fundamenten för ett säkert laborerande. Laboration
Vi gnider trasor mot ebonitstavar, glasstavar och kammar. Dessa blir då elektriskt uppladdade. Den elektrostatiskt laddade staven kan böja av en vattenstråle. Laddningarna i staven trycker undan den laddade vattenmolekylen. Detta visar att vatten är en dipol. Föreläsning
Här talar vi om sådant som står i boken om vattenmolekylens egenskaper.
Demonstration 2
Elektrolys av vatten ger syre och väte. Vi använde ett u-rör och två kolelektroder. I röret fanns svavelsyra utspädd med vatten. Spänningen var 24 volt. Vid båda elektroderna bildas gas. Den ena elektroden ger kraftigare gasutveckling. Gaserna samlas upp i vattenfyllda provrör. Efter cirka 15 minuter är det ena provröret halvfullt med gas och det andra är fullt. Det har alltså bildats dubbelt så mycket av den ena gasen. Den gas som det bildats mest av brinner med en puff om en tändare förs till. Detta visar att det är vätgas som bildats. Samma förfarande med en glödande sticka i den andra gasen (ska) visa att det är syrgas. Vi har alltså visat att vatten kan sönderdelas genom elektrolys till sina beståndsdelar syre och väte. 2H2O à 2 H2 + O2.
Demonstration 1 och 2 kan sammanfattas i 2H2O ßà 2 H2 + O2
2) Lektion
Innehåll
Denna lektion handlar om följande begrepp: Kokpunkt och fryspunkt. Temperatur enligt Celsius. Aggregationsformer. Empiriska metoder. Labsäkerhet
Vi går igenom hur brännarna fungerar. Inga brännare tänds utan tillstånd från läraren. Börja med att kontrollera att båda kranarna är stängda, både den på flaskan och den på själva brännaren. Öppna kranen på flaskan. Tänd en sticka och för mot brännarens öppning samtidigt som dess kran öppnas. Brännaren stängs av genom att kranen på flaskan stängs så att gasen i slangen får brinna ut. Därefter stängs kranen på brännaren.Om en brännare slocknar skall båda kranarna omedelbart stängas. Gasol är tyngre än luft och lägger sig på golvet om den kommer ut. Man känner kanske inte lukten av den innan det är för sent. Gasolbränder och dito explosioner är fruktansvärt farliga.
Eleverna ska lära sig namnen på och känna igen några av sakerna som används vid laborationer: klämmare, muff, stativ, bägare och skål. Demo: Vattnets fryspunkt och kokpunkt
Mät temperaturen i isvatten när vattnet kyls av isen eller snön. Värm vattnet. Hur kommer det sig att vatten kokar vid exakt 100oC? Observera att temperaturen inte börjar stiga förrän isen smält. Det åtgår alltså energi för att smälta isen. Sedan ökar temperaturen stadigt tills det att vattnet bringas i kokning. När vattnet kokar slutar temperaturen att öka. Ångan kan däremot vara varmare än det kokande vattnet.
Ett ämne kan ha olika aggregationsformer . Det är ett annat sätt att säga att ämnet kan var i olika tillstånd. Vi har nu sett att vatten kan finnas i tre tillstånd, fast, flytande eller gasformig. Detta är de tre aggregationsformerna. Så är fallet för alla ämnen även om kokpunkt och smältpunkt kan ligga avsevärt högre eller lägre. Gaser som syre och kväve kokar vid låga temperaturer. Flytande kväve har temperaturen –198oC (75 grader över den absoluta nollpunkten, även uttryckt som 75 grader Kelvin). Vid rumstemperatur är gaserna alltså gaser. Gaser i fast form finner man sällan i praktiken, men kolsyreis är ett exempel. Metaller å andra sidan har en smältpunkt som ligger avsevärt högre än rumstemperaturen. Tenn smälter vid 232oC. Och järn vid 1535oC.
När den kände vetenskapsmannen Celsius skapade sin temperaturskala behövde han ha en exakt punkt för nollan på skalan. På samma sätt ville han att 100 grader skulle vara en temperatur som som var lätt att jämföra med i verkligheten. Man kan säga att han valde att töja ut sin skala med 100 streck lagom mycket så att han täckte in det vardagliga livet. Varför valde Celsius att använda vatten för sina två fixpunkter i temperaturskalan? Ett skäl är att vatten finns lättillgängligt. Alla har en uppfattning om vatten. Alla har kokat vatten någon gång och de flesta har sett snö. Ett annat skäl är att vatten som allt annat i naturen följer naturlagarna. D.v.s., man kan upprepa ett experiment hur många gånger som helst och få samma resultat. Det kallas den empiriska metoden. Celsius reste land och rike kring och kokade vatten, mm. Han fann att trycket spelar roll för kokpunkten. Men vid normalt lufttryck är kokpunkten vid hundra grader. Vad kan på verka resultatet? Mätfel och andra faktorer, exempelvis orent vatten. Salt och glykol ändra smältpunkten.
3) Lektion
Laboration
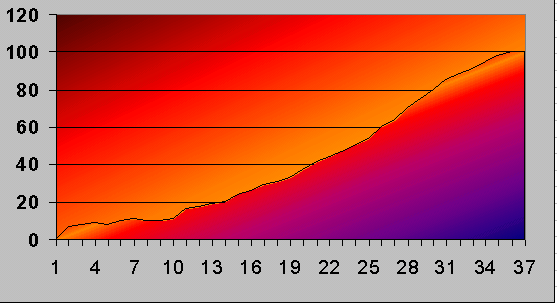
Lektionen är i datasalen där vi använder MS Excel för att plotta värdena från lektionen innan och gör kurvor.
Så här kan en typisk kurva se ut:
Fråga: Hur kommer det sig att temperaturen är precis 100 grader vid kokpunkten? Och exakt noll vid smältpunkten?
Svar: Därför att Celsius valde dessa fixpunkter för sin temperaturskala. Förklara detta utförligare.
4) Lektion
Innehåll
Ångans volym, gastryck Integrering av labsäkerhet
Regel ett. Rör ej grejor på katedern. Föreläsning
OH-bilder på temeperaturkurvorna.
Diskutera kring "Frågor om Anders Celsius".
1. När levde Anders Celsius?
2. Hur dog han?
3. Vilka resor gjorde han?
4. Blev han rik på sin forskning?
5. När kokar vatten enligt den temperaturskala som Anders Celsius använde?
6. Vem eller vilka förbättrade Celsius temperaturskala?
7. Vilka länkar har du hittat om Celsius mm?
8. Vilken länk var bäst?
9. Klipp in en bild på Anders Celsius här.
Demo 1,2,3: Egenskaper hos vattenånga
Anden i flaskan. Vad ser ni? Rök? Vattenånga. Fler gaser? Syre. Sätt en kork i. Det uppstår ett övertryck som skjuter iväg korken. Vad kan man mer observera? Värme, det kokar i botten. Hur ser den kemiska reaktionen ut? En kemisk reaktion kan beskrivas med ord men för att spara tid och utrymme brukar man skriva med grundämnenas förkortningar och symboler. Då kan det se ut så här: H2O2 + MnO2à H2O + O2 + Mn + värme Sätt en kork i flaskan när reaktionen börjar avta. Den sugs då ihop. Detta beror på att de varma gaserna i flaskan kyls av och att ångan kondenserar till vatten. Vatten tar mindre plats än ånga.
Ångtryck. Koka vatten tills en ballong spricker. Vattenånga tar plats och trycker på kraftigt. Precis som i en ångmaskin eller en ångturbin. Sätt på en ny ballong och värm. Känn på ångans temperatur. Låt svalna så sugs ballongen in. Värm igen så kommer den ut. Reversibel process, d.v.s. det kan gå fram och tillbaks flera gånger. Repeterbart.
Den hopknycklade ölburken. Koka en skvätt vatten i botten på en ölburk. Vän upp och ner i en bägare med vatten. Den knycklas ihop eftersom den heta ångan kyls av mot vattnet. Ångan återgår till att vara vatten. Vatten tar mycket mindre plats. Det blir vakuum i burken. Den trycks ihop av det omgivande lufttrycket.
5) Lektion
Labsäkerhet
Var försiktig vid användningen av utrustningen annars kan saker gå sönder! Följ instruktionerna. Regel två lyssna på instruktioner. Demonstration 1: Densitet hos fasta föremål och Arkimedes princip
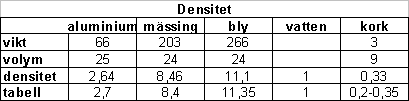
Arkimedes princip betyder att ett föremål som sänks ned i vatten tränger undan lika mycket vatten som dess volym. Om man sänker ner en metallklump i mätglas med vatten så ökar alltså vattennivån med lika många ml som volymen för metallklumpen.
Mätning av densitet. Vi mätte densiteten för cylinderformade föremål av aluminium, mässing och bly. Sedan användes ett mätglas för att mäta volymen. En brevvåg användes till att mäta vikten. En miniräknare (i en telefon) användes för att ta reda på densiteten hos några olika föremål. Densiteten får man genom att dela vikten med volymen. Om vikten är i gram och volymen mäts i kubuikcentimeter får man alltså densiteten i g/cm3. Det är bra att veta att 1 g/cm3 = 1 ml. På mätglasen är enheten ofta milliliter (ml).
Nu har vi mätt densitet för föremål som är tyngre än vatten. Vad har vatten själv för densitet? Jo vattnet har densiteten 1.0 g/cm3. 1 ml vatten väger alltså 1 gram. En liter vatten väger ett kilo.
Vi övergick nu till att mäta densiteten för kork. Samma mätmetod som tidigare visade på en intressant aspekt och ett problem. Korken flyter! För att mäta volymen på korken måste vi pressa ned den under vattenytan. Sedan gick uträkningarna som smort. Jag har samlat mätresultaten i en tabell nedan.
Laboration 1: Densitet hos fasta föremål och Arkimedes princip
Densiteten på is. Uppgiften är att hitta på en metod för att mäta densiteten hos is. Isbiten kan ju vägas på brevvågen. Men efter en kort diskussion kom vi fram till att det är olämpligt att mäta isens volym i ett mätglas med vatten eftersom isen kommer att smälta under tiden vi gör mätningen. Vi kom fram till ett nytt sätt att göra det på. Häll vatten i en engångsmugg av plast och frys in den. Undersök sedan hur mycket isens volym har ökat jämfört med vattnets. Innan vi satte muggen i frysen drog vi ett streck på muggen vid vattenytan.
6) Lektion
Labsäkerhet Laboration 1 fortsättning från lektionen innan
Is expanderar. Vi tittar på bägarna med vatten som fryst (från förra lektionen). Isen tar mer plats än vad vattnet gjorde. Densiteten är alltså lägre för is än för vatten. Sprickor i isen och utbuktning i muggens botten visar också att isen har expanderat. Den övre nivån är även högre än strecket. En ungefärlig uppskattning ger att isen tar cirka 10 % mer plats än vattnet. Densiteten är cirka tio procent lägre för is än för vatten. Densiteten för is är 0.9 g/cm3.
Demo 1: Densitet hos vätskor
Densitet betyder täthet. Ett annat sätt att uttrycka detta är att densitet betyder hur tung den är per volymenhet. Densitet mäts i gram per kubikcentimeter, g/cm3.
Densitet och skiktade vätskor. Vatten, matolja och T-röd hälles i tur och ordning i ett mätglas. Vätskorna skiktar sig. Den som har störst densitet lägger sig underst. Den näst tätaste lägger sig i mitten och den med lägst densitet lägger sig överst. Varför blir det så? Tänk dig två lika stora droppar av olika vätskor. Den som har högst densitet är också tyngs. Häller man dropparna i ett mätglas kommer den tunga (med högst densitet) att sjunka ner på botten. Den med lägre densitet kommer att flyta ovanpå. Om man släpper ner några fasta föremål i den treskiktade vätskan kommer dessa att sjunka ner genom de lättare vätskeskikten och flyta på de skikt som är tyngre än föremålet. En metallbit sjunker till botten. En kork flyter högst uppe på. En isbit flyter på vattenytan, men under oljan Demonstration 1 - varmt vatten är lättare
Vattens densitet är högre för kallt vatten än för varmt. Lilafärgat kallt vatten hälldes i ett fyrkantigt rör. Kokande vatten hälldes försiktigt ovanpå. Man kunde se att det skiktades så att det varma vattnet låg ovanpå det kalla. Demonstration 2 - salt vatten är tyngre än osalt
Salt vatten hälldes i nederdelen av ett fyrkantigt glasrör. Sedan fylldes vanligt osalt vatten på. Det skiktade sig så att det salta vattnet låg kvar på botten. Salt vatten har högre densitet än osalt vatten. När ett isberg vid nordpolen fryser på stannar saltet i vattnet. Detta vatten blir saltare och tyngre och sjunker därför. Någonstans måste detta vatten ta vägen när det sjunker till botten och det strömmar därför söderut. Här värms det och det varma ytvattnet strömmar mot norr där det sjunker igen i ett evigt kretslopp. Det som beskrivits här är Golfströmmen! Demonstration 3- varmt vatten stiger
Demonstration av golfströmmens värmeflöden. Vi hällde färg i ett glasrör med fyrkantig form. Genom att värma i ena nedre hörnet kunde man se hur detta fick vätskan att strömma runt i röret. Orsaken är att det varma vattnet stiger i röret och puttar undan det svalare vattnet i överkanten. Detta svalare vatten sjunker ner på den sidan där röret inte värms
7) Lektion
Demonstration 1
Demonstration av golfströmmens saltbalans. En balja med salt vatten har frysts in. Det visar sig att inte allt vatten blir is. Isen är nämligen osalt och det kvarvarande vattnet blir saltare och saltare vartefter isen fryser…. Kvar blir till sist vatten med så hög salthalt att … När det salta vattnet vid nordpolen fryser till is ökar salthalten i vattnet under isen. Detta salta vatten är tyngre än normalsaltat vatten. Det extrasaltade vattnet sjunker därför. Det har högre densitet. Det sjunkna vattnet ersätts av nytt vatten som strömmar till från sidan. I ett större perspektiv ser man att vatten strömmar från ekvatorn mot Antarktis där det sjunker till botten och rinner tillbaks efter botten mot ekvatorn samtidigt som salthalten blir jämnt fördelad.
Föreläsning
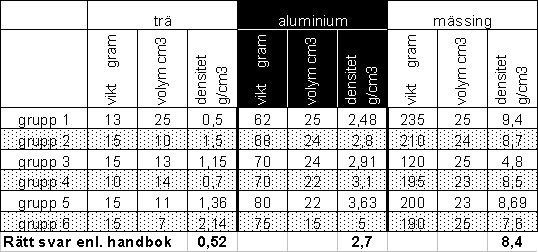
En tidigare grupp mätte densiteten som en laboration. De fick följande mätvärden. Varför denna variation? Tabellen nedan visar alla gruppers värden samt de korrekta värdena från tabell.
Demonstration 1
Gaser kan lösa sig i vatten. Löst kolsyra i fruktsoda frigörs och expanderar i en ballong. Försöket gick till så att jag öppnade en flaska med sockerdricka. En ballong träddes över öppningen och flaskan skakades. Ballongen blåstes upp av den kolsyra (koldioxid) som lösgjorde sig från vattnet. En gas kan alltså finnas löst i vatten. Fiskarna andas den luft som lösts i vattnet. I ett akvarium bubblar man in luft i vattnet för att gasen ska lösa sig i vattnet. Man säger att vattnet syresätts.
Demonstration 2
Gaser frigörs i kokande vatten. I botten på en glasbägare med vatten placeras en tratt. Tratten är upp och ned. På pipen placeras ett vattenfyllt provrör så att bubblor kan samlas upp. När vattnet värms frigörs en del av de lösta gaserna. Det bildas bubblor. Ju varmare vattnet blir desto mer gas frigörs. Mot slutet av uppvärmningen har all gas frigjorts, men nu pildas det istället bubblor av vattenånga. Denna ånga kondenserar i provröret. Vi lyckas samla upp ett par cm3 gas. Det finns helt klart mer löst gas i sockerdricka, men det är ändå en mätbar mängd gas löst i vanligt kranvatten.
Demonstration 3
Jag talade om hur en reaktionsformel ser ut. Exemplet var hur väte plus syre ger vattenånga. Jag demonstrerade detta genom att tända eld på ren vätgas från en gastub. Gasen fick brinna i luften. Luftens syre reagerade med vätgasen och ånga bildades. Ångan såg vi när den kondenserade på en glasbägare som hölls över lågan.
Laboration 1
Eftersom doppelektroderna för att mäta ledningsförmågan i vätskor fungerade dåligt är det svårt att göra några seriösa mätningar. Det går dock att vatten leder ström bättre under vissa förutsättningar, nämligen om det finns joner i vattnet.
Mätinstrumentet är en liten låda med lysdioder på ovansidan och två metallstänger på undersidan. Metallstängerna kallas elektroder. Lådan innehåller elektronik som skickar en ström genom elektroderna och vätskan som elektroderna doppats i. Ju mer ström det går desto fler lampor lyser.
Om man doppar elektroderna i vanligt kranvatten lyser en diod. Det visar att kranvatten inte är helt rent. Det innehåller en del joner. Om man häller litet syra eller bas i vattnet lyser två lampor. Detta visar att antalet joner har ökat. Syrorna som vi testade var: ättiksyra, saltsyra (HCl), svavelsyra (H2SO4). Baserna som vi testade var natriumhydroxid (NaOH) och ammoniak.
Demonstration 4
Leder vatten elektricitet. Elektrisk ledningsförmåga för vattenlösningar. Vi testar först avjoniserat (destillerat) vatten. Strömmen är mycket svag, i storleksordningen 1 mA. Sedan testar vi kranvatten och det leder bättre. Dock ej någon dramatisk skillnad. Kanske är det destillerade vattnet förorenat. Vi prövar även HCl och NaOH, båda utspädda med vatten, och finner att dessa vätskor leder mycket bättre. Nu går det omkring 100 mA.
När fasta ämnen löses i vatten bildas joner. Dessa joner är elektriskt laddade. Jonerna är delaktiga i att vattnet leder ström. Natriumklorid, bordssalt, NaCl bildar Na+ och Cl-. Natriumhydroxid, NaOH bildar Na+ och OH- (hydroxidjon). Väteklorid, saltsyra, HCl bildar H+ och Cl-.
8) Lektion
Demonstration 1 – vatten är ett bra lösningsmedel
Är vatten ett lösningsmedel. Lösningar av salt i vatten. Vattnet är vanligt kallvatten från kranen. Det tar en stund för saltet att lösa sig. Efter en stunds omrörning har ändå inte allt salt löst sig. Lösningen har blivit mättad. När lösningen sätts över en brännare dröjer det inte länge förrän allt salt har gått i lösning.
Demonstration 2 - indunstning av kranvatten.
Salt vatten från Demonstration 2 värms till kokning. Vattnet får koka bort. Bägare tas av lågan innan det är helt torrt för att den inte ska spricka. På bägarens botten finns nu intorkat salt. Här har vi sett de tre aggregationsformerna. Salt i fast form. Saltvatten i vätskefas. Vattenånga i gasfas.
Demonstration 3 - ytspänning.
Föremål av metall flyter under vissa omständigheter. Detta visades med en tunn bit av kopparplåt. Samma effekt fick vi med en tunn ståltråd som virats och formats till en X-form med fyra ben (avsikten var att efterlikna en insekt som går på vattenytan). Anledningen till att föremålen flyter är att ytspänningen beror på krafterna mellan vattenmolekylerna. Dessa krafter strävar efter att hålla ihop vattnet. Om diskmedel tillsätts sjunker föremålen eftersom ytspänningen då försvinner.
Om man betraktar ett tunt rör ser man hur ytspänningen gör att vattnet kryper uppåt efter väggarna och drar med sig vattenpelaren ett par mm uppåt. Här är det vattenmolekylernas laddning som gör att vattnet väter väggarna och kryper uppåt. Laboration 1 – saltat islyft
En isbit som ligger i vatten i en bägare är hal och svår att få grepp om. Om man lägger en bomullstråd på isbiten och sedan saltar på isen kan man snart (en till två minuter tar det) lyfta isbiten med hjälp av tråden. Isen har frusit fast i tråden. Varför? Jo saltet löser sig i vatten. När det sker går det åt energi i form av värme. Denna värme tas från vattnet kring isbiten. Detta avkylda vatten fryser då till is. Tråden fryser därvid fast. Detta är en spontan endoterm reaktion. Att den är spontan betyder att den sker av sig själv. Endoterm betyder att det går åt värme.
Demonstration 5 – syran och basen neutraliserar varandra
Vi undersökte pH för vatten i några olika varianter. Som indikator använde vi lackmuspapper. Detta papper ändrar färg efter lösningens pH-värde. Färgen är röd för sura lösningar och blå för basiska.
Först visade vanligt vatten ett pH-värde kring 7 eller något under. När vi blandade i lite utspädd HCl i vattnet blev det surt och pH-värdet sjönk mot ett. Vi testade basiskt vatten som blandats ut med NaOH. Detta pH-papper blev blått och värdet låg kring 14. När vi blandade lika delar surt och basiskt vatten blev pH neutralt igen.
9) Lektion
Prov
10)Lektion vattenledningssystemet Demo - kommunicerande kärl
Visa två kommunicerande kärl med färgat vatten. Höj och sänk dem. Analogi med vattentornet. Visa att ökad höjd ger ökat flöde. Visa glaskärlet med ett smalt rör, ett brett rör och ett rör med kupor. Demo - pumpen
Visa modellen av en pump. Demo - häverten
Laborera med sughäverten. Demo - avloppsröret
Visa att det inte gör något om avloppet följer marklinjen över en liten kulle, så länge som vatten trycker på från en högre höjd. Demo - vattentrycket ökar på djupet
Burken med tre hål i sidan. Vilken stråle blir längst, dvs känner högst tryck?
Mät även trycket under vattnet i en hink. Använd Douglas u-formade slang med vätska i balans som kopplats till en dosa med membran av en ballong.
Demo - reningsverket
Rena vatten genom filtrering och sedimentering. Demo - modell av vattentornet
Extramoment. Bygg en modell av ett vattentorn med hjälp av burkar och plastslangar eller sugrör. Man borde ha någon slags förgreningskoppling att använda. Demo - vattenklosetten
Extramoment. Vattentanken på en toalett är ett vattentorn i miniatyr. Demo - vattenlåset
Extramoment. Hur fungerar vattenlåset i handfatet eller toaletten? Demo -
Extramoment. Tratt slang och tratt med vätska. Alltid samma nivå. Som vattenpass vid målning av vattenlinje på båt.
övrigt som man skulle kunna göra
Häll varmt vatten i en (spolarvätske-) flaska. Korka igen eller sätt på en ballong och kyl ner.
Kommunicerande kärl, hävertar, mm.
Mg, Na, Ca i vatten.
Elda Mg i vattenånga.
Starka syror och baser
Neutralisation. NaOH + HCl à Na+ + Cl- + H2O
pH
Titta på iskristaller i mikroskop.
Tvättmedel och tensider.
Vatten och olja blandar sig inte. (liksom vinäger och olja) Den ena är en dipol, den andra inte.
Vattenmängden i några vanliga livsmedel. Torka i torkskåp. Väg före och efter.
Övergödning i naturen, jordbruket.
Reningsverket
Koka vatten i en pappersform
Torka livsmedel och räkna ut andelen vatten.
Anknyt till fotosyntesen. Vi människor består till 70 % av vatten. Vårt vattenbehov är 2.4 l per dag ??? vart tar det vägen?. Se i boken sid ??
Anders Celcius
Länkar om Celcius
http://www.astro.uu.se/history/Celsius_27nov2001.html
http://www.astro.uu.se/history/Celsius_eng.html
http://www.luth.se/th/TNCs/forsta_sida/vetenskapsman/celsius.html
http://www.santesson.com/celsupp.htm
http://www.texloc.com/closet/cl_cel_fah_chart.html
http://mac.buf.kristianstad.se/Degeberga/Elevarbeten/Celsius/Tragik
Laboration - vatten leder ström ibland
Koppartråd och järntråd i vatten och en strömkrets med batteri och lampa.
häll i salt och rör om. Vad händer?
Det uppstår en blå missfärgning. vad beror den på?
Demo löslighet i vatten - Instant Ice
http://www.schooltube.com/video/a9b774b5d97481cbb0ea/Instant-Ice