Vatten
Lektion 1 - Inledning
1) Lektion
Termer och begrepp
Stativ klämma, muff, bägare, degeltång. Ni ska lära er dessa begrepp för att vi ska kunna kommunicera smidigt. Effektiv kommunikation är ett av fundamenten för ett säkert laborerande. Laboration
Vi gnider trasor mot ebonitstavar, glasstavar och kammar. Dessa blir då elektriskt uppladdade. Den elektrostatiskt laddade staven kan böja av en vattenstråle. Laddningarna i staven trycker undan den laddade vattenmolekylen. Detta visar att vatten är en dipol. Föreläsning
Här talar vi om sådant som står i boken om vattenmolekylens egenskaper.
Demonstration 1
Vi eldar vätgas. Detta för att visa att det bildas vatten från reaktionen mellan luftens syre och väte. Vätgasen kommer från en gastub. Detta är samma experiment som Cavendish en gång gjorde, fast han såg till att där fanns exakt dubbelt så mycket väte som syre. Då såg han att det räckte precis för att skapa vatten. Dessutom vägde han gaserna och det bildade vattnet och såg att gaserna vägde lika mycket som det bildade vattnet. Ett praktiskt sätt att beskriva vad som händer är med reaktionsformeln är 2 H2 + O2 à 2H2O
Demonstration 2
Elektrolys av vatten ger syre och väte. Vi använde ett u-rör och två kolelektroder. I röret fanns svavelsyra utspädd med vatten. Spänningen var 24 volt. Vid båda elektroderna bildas gas. Den ena elektroden ger kraftigare gasutveckling. Gaserna samlas upp i vattenfyllda provrör. Efter cirka 15 minuter är det ena provröret halvfullt med gas och det andra är fullt. Det har alltså bildats dubbelt så mycket av den ena gasen. Den gas som det bildats mest av brinner med en puff om en tändare förs till. Detta visar att det är vätgas som bildats. Samma förfarande med en glödande sticka i den andra gasen (ska) visa att det är syrgas. Vi har alltså visat att vatten kan sönderdelas genom elektrolys till sina beståndsdelar syre och väte. 2H2O à 2 H2 + O2.
Demonstration 1 och 2 kan sammanfattas i 2H2O ßà 2 H2 + O2
2) Lektion
Innehåll
Denna lektion handlar om följande begrepp: Kokpunkt och fryspunkt. Temperatur enligt Celsius. Aggregationsformer. Empiriska metoder. Labsäkerhet
Vi går igenom hur brännarna fungerar. Inga brännare tänds utan tillstånd från läraren. Börja med att kontrollera att båda kranarna är stängda, både den på flaskan och den på själva brännaren. Öppna kranen på flaskan. Tänd en sticka och för mot brännarens öppning samtidigt som dess kran öppnas. Brännaren stängs av genom att kranen på flaskan stängs så att gasen i slangen får brinna ut. Därefter stängs kranen på brännaren.Om en brännare slocknar skall båda kranarna omedelbart stängas. Gasol är tyngre än luft och lägger sig på golvet om den kommer ut. Man känner kanske inte lukten av den innan det är för sent. Gasolbränder och dito explosioner är fruktansvärt farliga.
Eleverna ska lära sig namnen på och känna igen några av sakerna som används vid laborationer: klämmare, muff, stativ, bägare och skål. Demo: Vattnets fryspunkt och kokpunkt
Mät temperaturen i isvatten när vattnet kyls av isen eller snön. Värm vattnet. Hur kommer det sig att vatten kokar vid exakt 100oC? Observera att temperaturen inte börjar stiga förrän isen smält. Det åtgår alltså energi för att smälta isen. Sedan ökar temperaturen stadigt tills det att vattnet bringas i kokning. När vattnet kokar slutar temperaturen att öka. Ångan kan däremot vara varmare än det kokande vattnet.
Ett ämne kan ha olika aggregationsformer . Det är ett annat sätt att säga att ämnet kan var i olika tillstånd. Vi har nu sett att vatten kan finnas i tre tillstånd, fast, flytande eller gasformig. Detta är de tre aggregationsformerna. Så är fallet för alla ämnen även om kokpunkt och smältpunkt kan ligga avsevärt högre eller lägre. Gaser som syre och kväve kokar vid låga temperaturer. Flytande kväve har temperaturen –198oC (75 grader över den absoluta nollpunkten, även uttryckt som 75 grader Kelvin). Vid rumstemperatur är gaserna alltså gaser. Gaser i fast form finner man sällan i praktiken, men kolsyreis är ett exempel. Metaller å andra sidan har en smältpunkt som ligger avsevärt högre än rumstemperaturen. Tenn smälter vid 232oC. Och järn vid 1535oC.
När den kände vetenskapsmannen Celsius skapade sin temperaturskala behövde han ha en exakt punkt för nollan på skalan. På samma sätt ville han att 100 grader skulle vara en temperatur som som var lätt att jämföra med i verkligheten. Man kan säga att han valde att töja ut sin skala med 100 streck lagom mycket så att han täckte in det vardagliga livet. Varför valde Celsius att använda vatten för sina två fixpunkter i temperaturskalan? Ett skäl är att vatten finns lättillgängligt. Alla har en uppfattning om vatten. Alla har kokat vatten någon gång och de flesta har sett snö. Ett annat skäl är att vatten som allt annat i naturen följer naturlagarna. D.v.s., man kan upprepa ett experiment hur många gånger som helst och få samma resultat. Det kallas den empiriska metoden. Celsius reste land och rike kring och kokade vatten, mm. Han fann att trycket spelar roll för kokpunkten. Men vid normalt lufttryck är kokpunkten vid hundra grader. Vad kan på verka resultatet? Mätfel och andra faktorer, exempelvis orent vatten. Salt och glykol ändra smältpunkten.
3) Lektion
Laboration
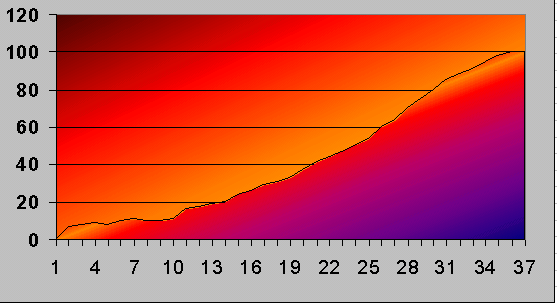
Lektionen är i datasalen där vi använder MS Excel för att plotta värdena från lektionen innan och gör kurvor.
Så här kan en typisk kurva se ut:
Fråga: Hur kommer det sig att temperaturen är precis 100 grader vid kokpunkten? Och exakt noll vid smältpunkten?
Svar: Därför att Celsius valde dessa fixpunkter för sin temperaturskala. Förklara detta utförligare.
4) Lektion
Innehåll
Ångans volym, gastryck Integrering av labsäkerhet
Regel ett. Rör ej grejor på katedern. Föreläsning
OH-bilder på temeperaturkurvorna.
Diskutera kring "Frågor om Anders Celsius".
1. När levde Anders Celsius?
2. Hur dog han?
3. Vilka resor gjorde han?
4. Blev han rik på sin forskning?
5. När kokar vatten enligt den temperaturskala som Anders Celsius använde?
6. Vem eller vilka förbättrade Celsius temperaturskala?
7. Vilka länkar har du hittat om Celsius mm?
8. Vilken länk var bäst?
9. Klipp in en bild på Anders Celsius här.
Demo 1,2,3: Egenskaper hos vattenånga
Anden i flaskan. Vad ser ni? Rök? Vattenånga. Fler gaser? Syre. Sätt en kork i. Det uppstår ett övertryck som skjuter iväg korken. Vad kan man mer observera? Värme, det kokar i botten. Hur ser den kemiska reaktionen ut? En kemisk reaktion kan beskrivas med ord men för att spara tid och utrymme brukar man skriva med grundämnenas förkortningar och symboler. Då kan det se ut så här: H2O2 + MnO2à H2O + O2 + Mn + värme Sätt en kork i flaskan när reaktionen börjar avta. Den sugs då ihop. Detta beror på att de varma gaserna i flaskan kyls av och att ångan kondenserar till vatten. Vatten tar mindre plats än ånga.
Ångtryck. Koka vatten tills en ballong spricker. Vattenånga tar plats och trycker på kraftigt. Precis som i en ångmaskin eller en ångturbin. Sätt på en ny ballong och värm. Känn på ångans temperatur. Låt svalna så sugs ballongen in. Värm igen så kommer den ut. Reversibel process, d.v.s. det kan gå fram och tillbaks flera gånger. Repeterbart.
Den hopknycklade ölburken. Koka en skvätt vatten i botten på en ölburk. Vän upp och ner i en bägare med vatten. Den knycklas ihop eftersom den heta ångan kyls av mot vattnet. Ångan återgår till att vara vatten. Vatten tar mycket mindre plats. Det blir vakuum i burken. Den trycks ihop av det omgivande lufttrycket.
5) Lektion
Labsäkerhet
Var försiktig vid användningen av utrustningen annars kan saker gå sönder! Följ instruktionerna. Regel två lyssna på instruktioner. Demonstration 1: Densitet hos fasta föremål och Arkimedes princip
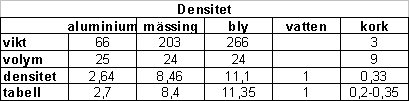
Arkimedes princip betyder att ett föremål som sänks ned i vatten tränger undan lika mycket vatten som dess volym. Om man sänker ner en metallklump i mätglas med vatten så ökar alltså vattennivån med lika många ml som volymen för metallklumpen.
Mätning av densitet. Vi mätte densiteten för cylinderformade föremål av aluminium, mässing och bly. Sedan användes ett mätglas för att mäta volymen. En brevvåg användes till att mäta vikten. En miniräknare (i en telefon) användes för att ta reda på densiteten hos några olika föremål. Densiteten får man genom att dela vikten med volymen. Om vikten är i gram och volymen mäts i kubuikcentimeter får man alltså densiteten i g/cm3. Det är bra att veta att 1 g/cm3 = 1 ml. På mätglasen är enheten ofta milliliter (ml).
Nu har vi mätt densitet för föremål som är tyngre än vatten. Vad har vatten själv för densitet? Jo vattnet har densiteten 1.0 g/cm3. 1 ml vatten väger alltså 1 gram. En liter vatten väger ett kilo.
Vi övergick nu till att mäta densiteten för kork. Samma mätmetod som tidigare visade på en intressant aspekt och ett problem. Korken flyter! För att mäta volymen på korken måste vi pressa ned den under vattenytan. Sedan gick uträkningarna som smort. Jag har samlat mätresultaten i en tabell nedan.
Laboration 1: Densitet hos fasta föremål och Arkimedes princip
Densiteten på is. Uppgiften är att hitta på en metod för att mäta densiteten hos is. Isbiten kan ju vägas på brevvågen. Men efter en kort diskussion kom vi fram till att det är olämpligt att mäta isens volym i ett mätglas med vatten eftersom isen kommer att smälta under tiden vi gör mätningen. Vi kom fram till ett nytt sätt att göra det på. Häll vatten i en engångsmugg av plast och frys in den. Undersök sedan hur mycket isens volym har ökat jämfört med vattnets. Innan vi satte muggen i frysen drog vi ett streck på muggen vid vattenytan.
6) Lektion
Labsäkerhet Laboration 1 fortsättning från lektionen innan
Is expanderar. Vi tittar på bägarna med vatten som fryst (från förra lektionen). Isen tar mer plats än vad vattnet gjorde. Densiteten är alltså lägre för is än för vatten. Sprickor i isen och utbuktning i muggens botten visar också att isen har expanderat. Den övre nivån är även högre än strecket. En ungefärlig uppskattning ger att isen tar cirka 10 % mer plats än vattnet. Densiteten är cirka tio procent lägre för is än för vatten. Densiteten för is är 0.9 g/cm3.
Demo 1: Densitet hos vätskor
Densitet betyder täthet. Ett annat sätt att uttrycka detta är att densitet betyder hur tung den är per volymenhet. Densitet mäts i gram per kubikcentimeter, g/cm3.
Densitet och skiktade vätskor. Vatten, matolja och T-röd hälles i tur och ordning i ett mätglas. Vätskorna skiktar sig. Den som har störst densitet lägger sig underst. Den näst tätaste lägger sig i mitten och den med lägst densitet lägger sig överst. Varför blir det så? Tänk dig två lika stora droppar av olika vätskor. Den som har högst densitet är också tyngs. Häller man dropparna i ett mätglas kommer den tunga (med högst densitet) att sjunka ner på botten. Den med lägre densitet kommer att flyta ovanpå. Om man släpper ner några fasta föremål i den treskiktade vätskan kommer dessa att sjunka ner genom de lättare vätskeskikten och flyta på de skikt som är tyngre än föremålet. En metallbit sjunker till botten. En kork flyter högst uppe på. En isbit flyter på vattenytan, men under oljan Demonstration 1 - varmt vatten är lättare
Vattens densitet är högre för kallt vatten än för varmt. Lilafärgat kallt vatten hälldes i ett fyrkantigt rör. Kokande vatten hälldes försiktigt ovanpå. Man kunde se att det skiktades så att det varma vattnet låg ovanpå det kalla. Demonstration 2 - salt vatten är tyngre än osalt
Salt vatten hälldes i nederdelen av ett fyrkantigt glasrör. Sedan fylldes vanligt osalt vatten på. Det skiktade sig så att det salta vattnet låg kvar på botten. Salt vatten har högre densitet än osalt vatten. När ett isberg vid nordpolen fryser på stannar saltet i vattnet. Detta vatten blir saltare och tyngre och sjunker därför. Någonstans måste detta vatten ta vägen när det sjunker till botten och det strömmar därför söderut. Här värms det och det varma ytvattnet strömmar mot norr där det sjunker igen i ett evigt kretslopp. Det som beskrivits här är Golfströmmen! Demonstration 3- varmt vatten stiger
Demonstration av golfströmmens värmeflöden. Vi hällde färg i ett glasrör med fyrkantig form. Genom att värma i ena nedre hörnet kunde man se hur detta fick vätskan att strömma runt i röret. Orsaken är att det varma vattnet stiger i röret och puttar undan det svalare vattnet i överkanten. Detta svalare vatten sjunker ner på den sidan där röret inte värms
7) Lektion
Demonstration 1
Demonstration av golfströmmens saltbalans. En balja med salt vatten har frysts in. Det visar sig att inte allt vatten blir is. Isen är nämligen osalt och det kvarvarande vattnet blir saltare och saltare vartefter isen fryser…. Kvar blir till sist vatten med så hög salthalt att … När det salta vattnet vid nordpolen fryser till is ökar salthalten i vattnet under isen. Detta salta vatten är tyngre än normalsaltat vatten. Det extrasaltade vattnet sjunker därför. Det har högre densitet. Det sjunkna vattnet ersätts av nytt vatten som strömmar till från sidan. I ett större perspektiv ser man att vatten strömmar från ekvatorn mot Antarktis där det sjunker till botten och rinner tillbaks efter botten mot ekvatorn samtidigt som salthalten blir jämnt fördelad.
Föreläsning
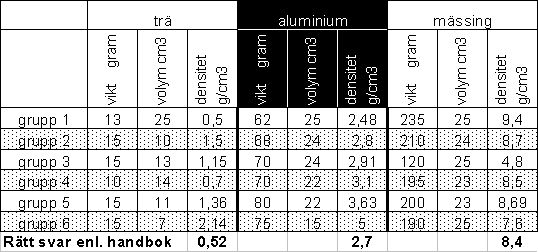
En tidigare grupp mätte densiteten som en laboration. De fick följande mätvärden. Varför denna variation? Tabellen nedan visar alla gruppers värden samt de korrekta värdena från tabell.
Demonstration 1
Gaser kan lösa sig i vatten. Löst kolsyra i fruktsoda frigörs och expanderar i en ballong. Försöket gick till så att jag öppnade en flaska med sockerdricka. En ballong träddes över öppningen och flaskan skakades. Ballongen blåstes upp av den kolsyra (koldioxid) som lösgjorde sig från vattnet. En gas kan alltså finnas löst i vatten. Fiskarna andas den luft som lösts i vattnet. I ett akvarium bubblar man in luft i vattnet för att gasen ska lösa sig i vattnet. Man säger att vattnet syresätts.
Demonstration 2
Gaser frigörs i kokande vatten. I botten på en glasbägare med vatten placeras en tratt. Tratten är upp och ned. På pipen placeras ett vattenfyllt provrör så att bubblor kan samlas upp. När vattnet värms frigörs en del av de lösta gaserna. Det bildas bubblor. Ju varmare vattnet blir desto mer gas frigörs. Mot slutet av uppvärmningen har all gas frigjorts, men nu pildas det istället bubblor av vattenånga. Denna ånga kondenserar i provröret. Vi lyckas samla upp ett par cm3 gas. Det finns helt klart mer löst gas i sockerdricka, men det är ändå en mätbar mängd gas löst i vanligt kranvatten.
Demonstration 3
Jag talade om hur en reaktionsformel ser ut. Exemplet var hur väte plus syre ger vattenånga. Jag demonstrerade detta genom att tända eld på ren vätgas från en gastub. Gasen fick brinna i luften. Luftens syre reagerade med vätgasen och ånga bildades. Ångan såg vi när den kondenserade på en glasbägare som hölls över lågan.
Laboration 1
Eftersom doppelektroderna för att mäta ledningsförmågan i vätskor fungerade dåligt är det svårt att göra några seriösa mätningar. Det går dock att vatten leder ström bättre under vissa förutsättningar, nämligen om det finns joner i vattnet.
Mätinstrumentet är en liten låda med lysdioder på ovansidan och två metallstänger på undersidan. Metallstängerna kallas elektroder. Lådan innehåller elektronik som skickar en ström genom elektroderna och vätskan som elektroderna doppats i. Ju mer ström det går desto fler lampor lyser.
Om man doppar elektroderna i vanligt kranvatten lyser en diod. Det visar att kranvatten inte är helt rent. Det innehåller en del joner. Om man häller litet syra eller bas i vattnet lyser två lampor. Detta visar att antalet joner har ökat. Syrorna som vi testade var: ättiksyra, saltsyra (HCl), svavelsyra (H2SO4). Baserna som vi testade var natriumhydroxid (NaOH) och ammoniak.
Demonstration 4
Leder vatten elektricitet. Elektrisk ledningsförmåga för vattenlösningar. Vi testar först avjoniserat (destillerat) vatten. Strömmen är mycket svag, i storleksordningen 1 mA. Sedan testar vi kranvatten och det leder bättre. Dock ej någon dramatisk skillnad. Kanske är det destillerade vattnet förorenat. Vi prövar även HCl och NaOH, båda utspädda med vatten, och finner att dessa vätskor leder mycket bättre. Nu går det omkring 100 mA.
När fasta ämnen löses i vatten bildas joner. Dessa joner är elektriskt laddade. Jonerna är delaktiga i att vattnet leder ström. Natriumklorid, bordssalt, NaCl bildar Na+ och Cl-. Natriumhydroxid, NaOH bildar Na+ och OH- (hydroxidjon). Väteklorid, saltsyra, HCl bildar H+ och Cl-.
8) Lektion
Demonstration 1 – vatten är ett bra lösningsmedel
Är vatten ett lösningsmedel. Lösningar av salt i vatten. Vattnet är vanligt kallvatten från kranen. Det tar en stund för saltet att lösa sig. Efter en stunds omrörning har ändå inte allt salt löst sig. Lösningen har blivit mättad. När lösningen sätts över en brännare dröjer det inte länge förrän allt salt har gått i lösning. Demonstration 2 - indunstning av kranvatten.
Salt vatten från Demonstration 2 värms till kokning. Vattnet får koka bort. Bägare tas av lågan innan det är helt torrt för att den inte ska spricka. På bägarens botten finns nu intorkat salt. Här har vi sett de tre aggregationsformerna. Salt i fast form. Saltvatten i vätskefas. Vattenånga i gasfas. Demonstration 3 - ytspänning.
Föremål av metall flyter under vissa omständigheter. Detta visades med en tunn bit av kopparplåt. Samma effekt fick vi med en tunn ståltråd som virats och formats till en X-form med fyra ben (avsikten var att efterlikna en insekt som går på vattenytan). Anledningen till att föremålen flyter är att ytspänningen beror på krafterna mellan vattenmolekylerna. Dessa krafter strävar efter att hålla ihop vattnet. Om diskmedel tillsätts sjunker föremålen eftersom ytspänningen då försvinner.
Om man betraktar ett tunt rör ser man hur ytspänningen gör att vattnet kryper uppåt efter väggarna och drar med sig vattenpelaren ett par mm uppåt. Här är det vattenmolekylernas laddning som gör att vattnet väter väggarna och kryper uppåt. Laboration 1 – saltat islyft
En isbit som ligger i vatten i en bägare är hal och svår att få grepp om. Om man lägger en bomullstråd på isbiten och sedan saltar på isen kan man snart (en till två minuter tar det) lyfta isbiten med hjälp av tråden. Isen har frusit fast i tråden. Varför? Jo saltet löser sig i vatten. När det sker går det åt energi i form av värme. Denna värme tas från vattnet kring isbiten. Detta avkylda vatten fryser då till is. Tråden fryser därvid fast. Detta är en spontan endoterm reaktion. Att den är spontan betyder att den sker av sig själv. Endoterm betyder att det går åt värme. Demonstration 4 – molnet i en flaska
Molnet i en flaska. En skvätt varmljummet vatten hälls i en stor PET-flaska. Sedan eldar man litet i flaskans mynning. Röken från elden innehåller stoft (partiklar). Från det varma vattnet kommer vattenånga men denna ånga syns inte förrän den bildar små droppar. Dessa droppar bildas genom kondensation på stoftpartiklarna. Runt varje partikel finns alltså litet vatten i form av en droppe. Om man klämmer på flaskan försvinner molnet (vattendropparna) eftersom vattnet övergår till ångfas vid högre tryck. Man kan säga att luften har större förmåga att lösa vattenånga vid ett högre tryck. Detta experiment efterliknar naturen där luften nere vid marken (högt tryck) är molnfri men där ångan kondenserar och bildar moln högre upp i atmosfären (lägre tryck). Demonstration 5 – syran och basen neutraliserar varandra
Vi undersökte pH för vatten i några olika varianter. Som indikator använde vi lackmuspapper. Detta papper ändrar färg efter lösningens pH-värde. Färgen är röd för sura lösningar och blå för basiska.
Först visade vanligt vatten ett pH-värde kring 7 eller något under. När vi blandade i lite utspädd HCl i vattnet blev det surt och pH-värdet sjönk mot ett. Vi testade basiskt vatten som blandats ut med NaOH. Detta pH-papper blev blått och värdet låg kring 14. När vi blandade lika delar surt och basiskt vatten blev pH neutralt igen.
9) Lektion
Prov
10)Lektion vattenledningssystemet Demo - kommunicerande kärl
Visa två kommunicerande kärl med färgat vatten. Höj och sänk dem. Analogi med vattentornet. Visa att ökad höjd ger ökat flöde. Visa glaskärlet med ett smalt rör, ett brett rör och ett rör med kupor. Demo - pumpen
Visa modellen av en pump. Demo - häverten
Laborera med sughäverten. Demo - avloppsröret
Visa att det inte gör något om avloppet följer marklinjen över en liten kulle, så länge som vatten trycker på från en högre höjd. Demo - vattentrycket ökar på djupet
Burken med tre hål i sidan. Vilken stråle blir längst, dvs känner högst tryck?
Mät även trycket under vattnet i en hink. Använd Douglas u-formade slang med vätska i balans som kopplats till en dosa med membran av en ballong.
Demo - reningsverket
Rena vatten genom filtrering och sedimentering. Demo - modell av vattentornet
Extramoment. Bygg en modell av ett vattentorn med hjälp av burkar och plastslangar eller sugrör. Man borde ha någon slags förgreningskoppling att använda. Demo - vattenklosetten
Extramoment. Vattentanken på en toalett är ett vattentorn i miniatyr. Demo - vattenlåset
Extramoment. Hur fungerar vattenlåset i handfatet eller toaletten? Demo -
Extramoment. Tratt slang och tratt med vätska. Alltid samma nivå. Som vattenpass vid målning av vattenlinje på båt.
övrigt som man skulle kunna göra
Häll varmt vatten i en (spolarvätske-) flaska. Korka igen eller sätt på en ballong och kyl ner.
Kommunicerande kärl, hävertar, mm.
Mg, Na, Ca i vatten.
Elda Mg i vattenånga.
Starka syror och baser
Neutralisation. NaOH + HCl à Na+ + Cl- + H2O
pH
Titta på iskristaller i mikroskop.
Tvättmedel och tensider.
Vatten och olja blandar sig inte. (liksom vinäger och olja) Den ena är en dipol, den andra inte.
Vattenmängden i några vanliga livsmedel. Torka i torkskåp. Väg före och efter.
Övergödning i naturen, jordbruket.
Reningsverket
Koka vatten i en pappersform
Torka livsmedel och räkna ut andelen vatten.
Anknyt till fotosyntesen. Vi människor består till 70 % av vatten. Vårt vattenbehov är 2.4 l per dag ??? vart tar det vägen?. Se i boken sid ??
Anders Celcius
Länkar om Celcius
http://www.astro.uu.se/history/Celsius_27nov2001.html
http://www.astro.uu.se/history/Celsius_eng.html
http://www.luth.se/th/TNCs/forsta_sida/vetenskapsman/celsius.html
http://www.santesson.com/celsupp.htm
http://www.texloc.com/closet/cl_cel_fah_chart.html
http://mac.buf.kristianstad.se/Degeberga/Elevarbeten/Celsius/Tragik
Laboration - vatten leder ström ibland
Koppartråd och järntråd i vatten och en strömkrets med batteri och lampa.
häll i salt och rör om. Vad händer?
Det uppstår en blå missfärgning. vad beror den på?