Atomen Fy2: Skillnad mellan sidversioner
Hakan (diskussion | bidrag) Ingen redigeringssammanfattning |
Hakan (diskussion | bidrag) |
||
| (41 mellanliggande sidversioner av samma användare visas inte) | |||
| Rad 1: | Rad 1: | ||
== Vad är en atom? == | |||
{{Heureka2 | 267-284}} | |||
Atomens diameter är cirka 0.1 nm. | Atomens diameter är cirka 0.1 nm. | ||
| Rad 4: | Rad 6: | ||
Atomnumret anger antalet protoner (=antalet elektroner). | Atomnumret anger antalet protoner (=antalet elektroner). | ||
Det mesta av atomens massa finns i kärnan soom har en diameteromkring 1-10 fm. | Det mesta av atomens massa finns i kärnan soom har en diameteromkring 1-10 fm. | ||
=== Elektronskal === | |||
Elektronkonfiguration anger hur elektronerna i en atom av visst atomnummer är arrangerade. Konfigurationen påverkar ämnets fysiska och kemiska egenskaper och bestämmer i vilken grupp och period i det periodiska systemet ämnet inplaceras. | |||
Ett annat namn på dessa kvanttillstånd är atomorbitaler. En förenklad bild för att beskriva dessa orbitaler, är att säga att elektronerna successivt fylls på i olika elektronskal som i sin tur byggs upp av underskal. Som grundregel fylls ett skal eller underskal innan ett nytt påbörjas, men undantag förekommer. | |||
<gallery> | |||
File:Electron shell 001 Hydrogen (diatomic nonmetal) - no label.svg|Väte som har atomnummer 1 | |||
Fil:Electron shell 008 Oxygen - no label.svg|Syre som har atomnummer 8 | |||
Fil:Electron shell 118 Ununoctium.svg|Ununoktium som har atomnummer 118 | |||
</gallery> | |||
== Excitation deexcitation == | |||
=== Spektrallinje === | |||
[[Fil:Spectral lines continuous.png|mini|Kontinuerligt spektrum]] | |||
[[Fil:Spectral lines emission.png|mini|Emissionslinjer]] | |||
[[Fil:Spectral lines absorption.png|mini|Absorptionslinjer]] | |||
[[Fil:Spectre.svg|miniatyr|Det elektromagnetiska spektrumets olika våglängder; synligt ljus i detalj.]] | |||
[[Fil:Compact-Disc-spectrum-Mercury.jpg | thumb | 'Spektralcirklar' från en kvicksilverlampa fotograferade genom en CD-skiva.]] | |||
'''Spektrallinjer''' är ljusa eller mörka linjer i spektrumet från en ljuskälla. De uppstår när elektronerna i ljuskällans (eller mellanliggande materias) atomer övergår från en energinivå till en annan. Eftersom dessa energinivåer (och skillnaden mellan dem) är fasta och specifika för varje enskilt ämne, kan spektrallinjerna användas för att identifiera vilket eller vilka ämnen som är inblandade. | |||
* Absorptionslinjer (mörka linjer, de Fraunhoferska linjerna) uppstår när fotoner i ljuset absorberas, och elektronerna med hjälp av fotonernas energi går från ett lägre tillstånd till ett högre. | |||
* Emissionslinjer (ljusa linjer) uppstår när elektronerna går från ett högre tillstånd till ett lägre, och atomerna därvid avger fotoner som motsvarar skillnaden i energitillstånden. | |||
{{svwp | Spektrallinje}} | |||
{{svwp | Solen}} om du vill veta varför solens ljus är kontinuerligt i det synliga spektrat. | |||
{{clear}} | |||
=== Strålning === | |||
{{Gleerups|[https://gleerupsportal.se/laromedel/impuls-2/article/112104ea-aeca-4946-8b0d-6e0f2b4562ad Väteatomen]}}<br> | |||
Om en elektron flyttar till ett skal länge ut kallas atomen exciterad. Det går åt energi för detta. När elektronen återgår till sitt normaltillstånd (ursprungsnivån) utsänds energi i form av strålning. | Om en elektron flyttar till ett skal länge ut kallas atomen exciterad. Det går åt energi för detta. När elektronen återgår till sitt normaltillstånd (ursprungsnivån) utsänds energi i form av strålning. | ||
<math> hf = | {{Gleerups|[https://gleerupsportal.se/laromedel/impuls-2/article/62680c18-c5f1-4a93-9706-7d2dcc198ac7 Bohrs atommodell]}}<br> | ||
<math> hf = E_{före} - E_{efter} </math> | |||
=== Energinivåer === | |||
[[Image:Bohr-atom-PAR.svg|thumb| left |340px|The '''Rutherford–Bohr model''' of the hydrogen atom]] | |||
[[Fil:A hidrogen szinkepei.jpg|miniatyr| 340px |Bohratomens spektralvåglängder]] | |||
{{clear}} | |||
Läs mer på en bra sida: [http://olleh.se/start/teori/teori-atom.htm olleh] | |||
Ett mycket bra [http://www.physast.uga.edu/~rls/1020/ch4/elevels.jpg enerignivådiagram] | |||
{{clear}} | |||
=== Spektrallinjer === | |||
Strålningens våglängd (frekvens bestäms av eerginivåerna. Det innebär att en exciterad gas sänder ut strålning i ett linjespektrum. Det gäller för en atomär gas. En molekylär gas ger upphov till ett bandspektrum. Fria atomer och molekyler absorberar och emitterar alltså bestämdaa energikvanta. | Strålningens våglängd (frekvens bestäms av eerginivåerna. Det innebär att en exciterad gas sänder ut strålning i ett linjespektrum. Det gäller för en atomär gas. En molekylär gas ger upphov till ett bandspektrum. Fria atomer och molekyler absorberar och emitterar alltså bestämdaa energikvanta. | ||
Vilka våglängder som sänds ut från en exciterad atom eller molkyl är olika för olika grundämnen och molekyler. Våglängden beror på energigapet mellan atomens elektronskal. Strålningen från ett (upphettat)fast material har däremot ett kontinuerligt spektrum. | Vilka våglängder som sänds ut från en exciterad atom eller molkyl är olika för olika grundämnen och molekyler. Våglängden beror på energigapet mellan atomens elektronskal. Strålningen från ett (upphettat)fast material har däremot ett kontinuerligt spektrum. | ||
En atom joniseras om en elektron tillförs så mycket energi att den slås loss från atomen. Om man sätter eenrginivån till noll vid jonisationsnivån för en atom bestäms energin som krävs för att jonisera en atom av formeln | En atom joniseras om en elektron tillförs så mycket energi att den slås loss från atomen. Om man sätter eenrginivån till noll vid jonisationsnivån för en atom bestäms energin som krävs för att jonisera en atom av formeln | ||
<math>E_n = - \frac{ | <math>E_n = - \frac{E_R}{n^2} </math> | ||
där n är anger energinivån för en elektron i ett skal. I grundtillståndet (oexciterat) är <math> n = 1. E_r</math> är <math> 13.6 eV </math> för en väteatom | där n är anger energinivån för en elektron i ett skal. I grundtillståndet (oexciterat) är <math> n = 1. E_r</math> är <math> 13.6 eV </math> för en väteatom | ||
=== Rydbergs formel === | |||
[[Bild:Rydbergformula.jpg|thumb|Rydbergs formel i ett protokoll från 5 november 1888]] | |||
'''Rydbergs formel''' upptäcktes 1888 av fysikern Janne Rydberg för att beräkna spektrallinjer från atomer. Han hade upptäckt en regelbundenhet i vågtalen av spektralserier som kunde skrivas som (för '''väteatomen''') | |||
:<math>{1 \over \lambda} = R \left(\frac{1}{n^{2}} - \frac{1}{m^2}\right)</math> | |||
där λ är det utstrålade ljusets våglängd, ''m'' och ''n'' är heltal sådana att ''m''>''n''. <math>R</math> är en universell konstant, som nu kallas '''Rydbergs konstant'''. | |||
{{svwp|Rydbergs_formel}} | |||
{{clear}} | |||
=== Hur exciteras atomer? === | |||
[[File:High Pressure Sodium Lamp Spectrum.jpg| right | 340px | High Pressure Sodium Lamp Spectrum]] | |||
[[File:High pressure sodium lamp.svg| right | 340px |High pressure sodium lamp]] | |||
Atomer exciteras genom kollision med '''fotoner''', '''elektroner''' eller andra partiklar exempelvis '''atomer'''. för at en atom ska exciteras måste fotonens energi vara lika eller större än skillnaden ienerginivå mellan skalen som elektronen hopapr mellan. Om vitt ljus passerar genom en gas kommer ljus med rätt våglängd att excitera atomer till motsvarnde högre energinivåer. Det uppstår ett absorptionsspektrum med mörka linjer för de våglängder som motsvarar excitationsergierna. | |||
Alltså: | |||
* fria elektroner kolliderar med atomens elektron och lämnar lagom mycket energi för excitation | |||
* Fotoner med exakt rätt enerigmångd exciterar | |||
* en gas som väms tillräckligt ger kollisioner mellan atomer varvid atomer exciteras. | |||
Läs om hur elektroner exciterar natriumånga i: {{enwp |Sodium-vapor_lamp}} | |||
{{clear}} | |||
=== Röntgenspektrum === | |||
=== Elektronspektrum === | |||
== Vågfunktioner == | |||
Elektronerna i en atom kan beskrivas som vågfunktioner. | Elektronerna i en atom kan beskrivas som vågfunktioner. | ||
Nuvarande version från 19 april 2018 kl. 12.02
Vad är en atom?
Atomens diameter är cirka 0.1 nm.
Atomnumret anger antalet protoner (=antalet elektroner).
Det mesta av atomens massa finns i kärnan soom har en diameteromkring 1-10 fm.
Elektronskal
Elektronkonfiguration anger hur elektronerna i en atom av visst atomnummer är arrangerade. Konfigurationen påverkar ämnets fysiska och kemiska egenskaper och bestämmer i vilken grupp och period i det periodiska systemet ämnet inplaceras.
Ett annat namn på dessa kvanttillstånd är atomorbitaler. En förenklad bild för att beskriva dessa orbitaler, är att säga att elektronerna successivt fylls på i olika elektronskal som i sin tur byggs upp av underskal. Som grundregel fylls ett skal eller underskal innan ett nytt påbörjas, men undantag förekommer.
-
Väte som har atomnummer 1
-
Syre som har atomnummer 8
-
Ununoktium som har atomnummer 118
Excitation deexcitation
Spektrallinje





Spektrallinjer är ljusa eller mörka linjer i spektrumet från en ljuskälla. De uppstår när elektronerna i ljuskällans (eller mellanliggande materias) atomer övergår från en energinivå till en annan. Eftersom dessa energinivåer (och skillnaden mellan dem) är fasta och specifika för varje enskilt ämne, kan spektrallinjerna användas för att identifiera vilket eller vilka ämnen som är inblandade.
- Absorptionslinjer (mörka linjer, de Fraunhoferska linjerna) uppstår när fotoner i ljuset absorberas, och elektronerna med hjälp av fotonernas energi går från ett lägre tillstånd till ett högre.
- Emissionslinjer (ljusa linjer) uppstår när elektronerna går från ett högre tillstånd till ett lägre, och atomerna därvid avger fotoner som motsvarar skillnaden i energitillstånden.
Wikipedia skriver om Spektrallinje Wikipedia skriver om Solen om du vill veta varför solens ljus är kontinuerligt i det synliga spektrat.
Strålning
Om en elektron flyttar till ett skal länge ut kallas atomen exciterad. Det går åt energi för detta. När elektronen återgår till sitt normaltillstånd (ursprungsnivån) utsänds energi i form av strålning.
[math]\displaystyle{ hf = E_{före} - E_{efter} }[/math]
Energinivåer


Läs mer på en bra sida: olleh
Ett mycket bra enerignivådiagram
Spektrallinjer
Strålningens våglängd (frekvens bestäms av eerginivåerna. Det innebär att en exciterad gas sänder ut strålning i ett linjespektrum. Det gäller för en atomär gas. En molekylär gas ger upphov till ett bandspektrum. Fria atomer och molekyler absorberar och emitterar alltså bestämdaa energikvanta.
Vilka våglängder som sänds ut från en exciterad atom eller molkyl är olika för olika grundämnen och molekyler. Våglängden beror på energigapet mellan atomens elektronskal. Strålningen från ett (upphettat)fast material har däremot ett kontinuerligt spektrum.
En atom joniseras om en elektron tillförs så mycket energi att den slås loss från atomen. Om man sätter eenrginivån till noll vid jonisationsnivån för en atom bestäms energin som krävs för att jonisera en atom av formeln
[math]\displaystyle{ E_n = - \frac{E_R}{n^2} }[/math]
där n är anger energinivån för en elektron i ett skal. I grundtillståndet (oexciterat) är [math]\displaystyle{ n = 1. E_r }[/math] är [math]\displaystyle{ 13.6 eV }[/math] för en väteatom
Rydbergs formel
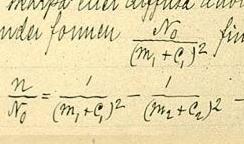
Rydbergs formel upptäcktes 1888 av fysikern Janne Rydberg för att beräkna spektrallinjer från atomer. Han hade upptäckt en regelbundenhet i vågtalen av spektralserier som kunde skrivas som (för väteatomen)
- [math]\displaystyle{ {1 \over \lambda} = R \left(\frac{1}{n^{2}} - \frac{1}{m^2}\right) }[/math]
där λ är det utstrålade ljusets våglängd, m och n är heltal sådana att m>n. [math]\displaystyle{ R }[/math] är en universell konstant, som nu kallas Rydbergs konstant.
Wikipedia skriver om Rydbergs_formel
Hur exciteras atomer?

Atomer exciteras genom kollision med fotoner, elektroner eller andra partiklar exempelvis atomer. för at en atom ska exciteras måste fotonens energi vara lika eller större än skillnaden ienerginivå mellan skalen som elektronen hopapr mellan. Om vitt ljus passerar genom en gas kommer ljus med rätt våglängd att excitera atomer till motsvarnde högre energinivåer. Det uppstår ett absorptionsspektrum med mörka linjer för de våglängder som motsvarar excitationsergierna.
Alltså:
- fria elektroner kolliderar med atomens elektron och lämnar lagom mycket energi för excitation
- Fotoner med exakt rätt enerigmångd exciterar
- en gas som väms tillräckligt ger kollisioner mellan atomer varvid atomer exciteras.
Läs om hur elektroner exciterar natriumånga i: Wikipedia:Sodium-vapor_lamp
Röntgenspektrum
Elektronspektrum
Vågfunktioner
Elektronerna i en atom kan beskrivas som vågfunktioner.



